Bieżący numer
O czasopiśmie
Rada Naukowa
Kolegium Redakcyjne
Polityka prawno-archiwizacyjna
Kodeks etyki publikacyjnej
Wydawca
Informacja o przetwarzaniu danych osobowych w ramach plików cookies oraz subskrypcji newslettera
Archiwum
Dla autorów
Dla recenzentów
Kontakt
Recenzenci
Recenzenci rocznika 2025
Recenzenci rocznika 2024
Recenzenci rocznika 2023
Recenzenci rocznika 2022
Recenzenci rocznika 2021
Recenzenci rocznika 2020
Recenzenci rocznika 2019
Recenzenci rocznika 2018
Recenzenci rocznika 2017
Recenzenci rocznika 2016
Recenzenci rocznika 2015
Recenzenci rocznika 2014
Recenzenci rocznika 2013
Recenzenci rocznika 2012
Polecamy
Śląski Uniwersytet Medyczny w Katowicach
Sklep Wydawnictw SUM
Biblioteka Główna SUM
Polityka prywatności
Deklaracja dostępności
Recenzenci
Recenzenci rocznika 2025
Recenzenci rocznika 2024
Recenzenci rocznika 2023
Recenzenci rocznika 2022
Recenzenci rocznika 2021
Recenzenci rocznika 2020
Recenzenci rocznika 2019
Recenzenci rocznika 2018
Recenzenci rocznika 2017
Recenzenci rocznika 2016
Recenzenci rocznika 2015
Recenzenci rocznika 2014
Recenzenci rocznika 2013
Recenzenci rocznika 2012
Wpływ perfenazyny na przeżywalność różnych linii komórkowych glejaków
1
Department of Drug and Cosmetics Technology, Faculty of Pharmaceutical Sciences in Sosnowiec, Medical University of Silesia, Katowice, Poland
2
Center for Natural and Human Sciences, Federal University of ABC, Santo André, São Paulo State, Brazil
3
Department of Toxicology, Toxicological Analysis and Bioanalysis, Faculty of Pharmaceutical Sciences in Sosnowiec, Medical University of Silesia, Katowice, Poland
Autor do korespondencji
Michał Otręba
Zakład Technologii Środków Leczniczych i Kosmetycznych, Wydział Nauk Farmaceutycznych w Sosnowcu, ul. Jedności 8, 41-200 Sosnowiec
Zakład Technologii Środków Leczniczych i Kosmetycznych, Wydział Nauk Farmaceutycznych w Sosnowcu, ul. Jedności 8, 41-200 Sosnowiec
Ann. Acad. Med. Siles. 2025;79:206-212
SŁOWA KLUCZOWE
DZIEDZINY
STRESZCZENIE
Wstęp:
Mimo postępu medycyny glejak wielopostaciowy (glioblastoma multiforme – GBM) jest nadal najczęstszym złośliwym pierwotnym guzem mózgu. Ponadto złoty standard leczenia charakteryzuje się niską (tylko 12–15 miesięcy) medianą przeżycia. Zatem ponowne wykorzystanie istniejących leków (repurposing) może być pomocną strategią w odkrywaniu skuteczniejszych leków chemioterapeutycznych w terapii GBM. Co ciekawe, pochodne fenotiazyny zostały uznane za obiecującego kandydata do ponownego wykorzystania leku w terapii nowotworowej, gdyż posiadają wiele istotnych aktywności biologicznych, takich jak działanie przeciwnowotworowe, przeciwbakteryjne, przeciwgrzybicze i przeciwwirusowe.
Materiał i metody:
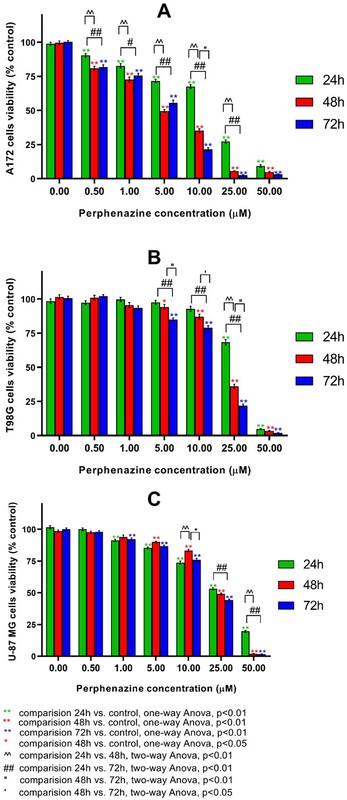
Wpływ perfenazyny na przeżywalność różnych linii komórkowych ludzkiego glejaka wielopostaciowego (U-87 MG, A172 i T98G) po 24-, 48- i 72-godzinnej inkubacji zbadano z użyciem testu WST-1.
Wyniki:
Wykazano, że testowana pochodna fenotiazyny zmniejsza żywotność glejaka wielopostaciowego w sposób zależny od czasu i stężenia.
Wnioski:
Na podstawie uzyskanych wartości EC50 stwierdzono, że perfenazyna jest najskuteczniejsza przeciwko ludzkiemu glejakowi wielopostaciowemu A172 w porównaniu z komórkami T98G i U-87 MG. Na podstawie poprzednich badań, które wykazały, że perfenazyna nie wpływa na normalne ludzkie astrocyty, można stwierdzić, że lek ten jest obiecującym kandydatem w leczeniu glejaka wielopostaciowego. Konieczne są dalsze badania w celu odkrycia pełnego mechanizmu aktywności przeciwnowotworowej pochodnych fenotiazyny w terapii GBM.
Mimo postępu medycyny glejak wielopostaciowy (glioblastoma multiforme – GBM) jest nadal najczęstszym złośliwym pierwotnym guzem mózgu. Ponadto złoty standard leczenia charakteryzuje się niską (tylko 12–15 miesięcy) medianą przeżycia. Zatem ponowne wykorzystanie istniejących leków (repurposing) może być pomocną strategią w odkrywaniu skuteczniejszych leków chemioterapeutycznych w terapii GBM. Co ciekawe, pochodne fenotiazyny zostały uznane za obiecującego kandydata do ponownego wykorzystania leku w terapii nowotworowej, gdyż posiadają wiele istotnych aktywności biologicznych, takich jak działanie przeciwnowotworowe, przeciwbakteryjne, przeciwgrzybicze i przeciwwirusowe.
Materiał i metody:
Wpływ perfenazyny na przeżywalność różnych linii komórkowych ludzkiego glejaka wielopostaciowego (U-87 MG, A172 i T98G) po 24-, 48- i 72-godzinnej inkubacji zbadano z użyciem testu WST-1.
Wyniki:
Wykazano, że testowana pochodna fenotiazyny zmniejsza żywotność glejaka wielopostaciowego w sposób zależny od czasu i stężenia.
Wnioski:
Na podstawie uzyskanych wartości EC50 stwierdzono, że perfenazyna jest najskuteczniejsza przeciwko ludzkiemu glejakowi wielopostaciowemu A172 w porównaniu z komórkami T98G i U-87 MG. Na podstawie poprzednich badań, które wykazały, że perfenazyna nie wpływa na normalne ludzkie astrocyty, można stwierdzić, że lek ten jest obiecującym kandydatem w leczeniu glejaka wielopostaciowego. Konieczne są dalsze badania w celu odkrycia pełnego mechanizmu aktywności przeciwnowotworowej pochodnych fenotiazyny w terapii GBM.
REFERENCJE (18)
1.
Lan Z., Li X., Zhang X. Glioblastoma: An update in pathology, molecular mechanisms and biomarkers. Int. J. Mol. Sci. 2024; 25(5): 3040, doi: 10.3390/ijms25053040.
2.
Astrocytoma: Grade 4 – Glioblastoma (GBM). National Brain Tumor Society [online] https://braintumor.org/events/... [accessed on 9 July 2024].
3.
Siegel R.L., Giaquinto A.N., Jemal A. Cancer statistics, 2024. CA Cancer J. Clin. 2024; 74(1): 12–49, doi: 10.3322/caac.21820.
4.
Brain CNS [pdf]. Global Cancer Observatory: Cancer Today / International Agency for Research on Cancer [online] https://gco.iarc.who.int/media... [accessed on 9 July 2024].
5.
Lopes R.M., Souza A.C.S., Otręba M., Rzepecka-Stojko A., Tersariol I.L.S., Rodrigues T. Targeting autophagy by antipsychotic phenothiazines: potential drug repurposing for cancer therapy. Biochem. Pharmacol. 2024; 222: 116075, doi: 10.1016/j.bcp.2024.116075.
6.
Cerner Multum. Perphenazine. Drugs.com: Know more. Be sure, Aug 3, 2023 [online] https://www.drugs.com/mtm/perp... [accessed on 9 July 2024].
7.
Edinoff A.N., Armistead G., Rosa C.A., Anderson A., Patil R., Cornett E.M. et al. Phenothiazines and their evolving roles in clinical practice: A narrative review. Health Psychol. Res. 2022; 10(4): 38930, doi: 10.52965/001c.38930.
8.
Jeleń M., Morak-Młodawska B., Korlacki R. Anticancer activities of tetra-, penta-, and hexacyclic phenothiazines modified with quinoline moiety. J. Mol. Struct. 2023; 1287: 135700, doi: 10.1016/j.molstruc.2023.135700.
9.
Otręba M., Kośmider L., Rzepecka-Stojko A. Antiviral activity of chlorpromazine, fluphenazine, perphenazine, prochlorperazine, and thioridazine towards RNA-viruses. A review. Eur. J. Pharmacol. 2020; 887: 173553, doi: 10.1016/j.ejphar.2020.173553.
10.
Otręba M., Kośmider L. In vitro anticancer activity of fluphenazine, perphenazine and prochlorperazine. A review. J. Appl. Toxicol. 2021; 41(1): 82–94, doi: 10.1002/jat.4046.
11.
Mello J.C., Moraes V.W., Watashi C.M., da Silva D.C., Cavalcanti L.P., Franco M.K. et al. Enhancement of chlorpromazine antitumor activity by Pluronics F127/L81 nanostructured system against human multidrug resistant leukemia. Pharmacol. Res. 2016; 111: 102–112, doi: 10.1016/j.phrs.2016.05.032.
12.
Otręba M., Wrześniok D., Rok J., Beberok A., Buszman E. Prochlorperazine interaction with melanin and melanocytes. Pharmazie 2017; 72(3): 171–176, doi: 10.1691/ph.2017.6787.
13.
Gil-Ad I., Shtaif B., Levkovitz Y., Dayag M., Zeldich E., Weizman A. Characterization of phenothiazine-induced apoptosis in neuroblastoma and glioma cell lines: clinical relevance and possible application for brain-derived tumors. J. Mol. Neurosci. 2004; 22(3): 189–198, doi: 10.1385/JMN:22:3:189.
14.
Tzadok S., Beery E., Israeli M., Uziel O., Lahav M., Fenig E. et al. In vitro novel combinations of psychotropics and anti-cancer modalities in U87 human glioblastoma cells. Int. J. Oncol. 2010; 37(4): 1043–1051, doi: 10.3892/ijo_00000756.
15.
Cheng H.W., Liang Y.H., Kuo Y.L., Chuu C.P., Lin C.Y., Lee M.H. et al. Identification of thioridazine, an antipsychotic drug, as an antiglioblastoma and anticancer stem cell agent using public gene expression data. Cell Death Dis. 2015; 6(5): e1753, doi: 10.1038/cddis.2015.77.
16.
Otręba M., Buszman E. Perphenazine and prochlorperazine induce concentration-dependent loss in human glioblastoma cells viability. Pharmazie 2018; 73(1): 19–21, doi: 10.1691/ph.2018.7806.
17.
Jacob J.R., Palanichamy K., Chakravarti A. Antipsychotics possess anti-glioblastoma activity by disrupting lysosomal function and inhibiting oncogenic signaling by stabilizing PTEN. Cell Death Dis. 2024; 15(6): 414, doi: 10.1038/s41419-024-06779-3.
18.
Otręba M., Rzepecka-Stojko A., Stojko J., Kabała-Dzik A., Kleczka A. Effect of perphenazine and prochlorperazine on viability of human astrocytes. Ann. Acad. Med. Siles. 2024; 78: 167–172, doi: 10.18794/aams/177539.
Udostępnij
ARTYKUŁ POWIĄZANY
Śląski Uniwersytet Medyczny w Katowicach, jako Operator Serwisu annales.sum.edu.pl, przetwarza dane osobowe zbierane podczas odwiedzania Serwisu. Realizacja funkcji pozyskiwania informacji o Użytkownikach i ich zachowaniu odbywa się poprzez dobrowolnie wprowadzone w formularzach informacje, zapisywanie w urządzeniach końcowych plików cookies (tzw. ciasteczka), a także poprzez gromadzenie logów serwera www, będącego w posiadaniu Operatora Serwisu. Dane, w tym pliki cookies, wykorzystywane są w celu realizacji usług zgodnie z Polityką prywatności.
Możesz wyrazić zgodę na przetwarzanie danych w tych celach, odmówić zgody lub uzyskać dostęp do bardziej szczegółowych informacji.
Możesz wyrazić zgodę na przetwarzanie danych w tych celach, odmówić zgody lub uzyskać dostęp do bardziej szczegółowych informacji.