Bieżący numer
O czasopiśmie
Rada Naukowa
Kolegium Redakcyjne
Polityka prawno-archiwizacyjna
Kodeks etyki publikacyjnej
Wydawca
Informacja o przetwarzaniu danych osobowych w ramach plików cookies oraz subskrypcji newslettera
Archiwum
Dla autorów
Dla recenzentów
Kontakt
Recenzenci
Recenzenci rocznika 2025
Recenzenci rocznika 2024
Recenzenci rocznika 2023
Recenzenci rocznika 2022
Recenzenci rocznika 2021
Recenzenci rocznika 2020
Recenzenci rocznika 2019
Recenzenci rocznika 2018
Recenzenci rocznika 2017
Recenzenci rocznika 2016
Recenzenci rocznika 2015
Recenzenci rocznika 2014
Recenzenci rocznika 2013
Recenzenci rocznika 2012
Polecamy
Śląski Uniwersytet Medyczny w Katowicach
Sklep Wydawnictw SUM
Biblioteka Główna SUM
Polityka prywatności
Deklaracja dostępności
Recenzenci
Recenzenci rocznika 2025
Recenzenci rocznika 2024
Recenzenci rocznika 2023
Recenzenci rocznika 2022
Recenzenci rocznika 2021
Recenzenci rocznika 2020
Recenzenci rocznika 2019
Recenzenci rocznika 2018
Recenzenci rocznika 2017
Recenzenci rocznika 2016
Recenzenci rocznika 2015
Recenzenci rocznika 2014
Recenzenci rocznika 2013
Recenzenci rocznika 2012
Wpływ powszechnych chorób przewlekłych na nasilenie objawów klinicznych COVID-19
1
Department of Medical Biophysics, Faculty of Medical Sciences in Katowice, Medical University of Silesia, Katowice, Poland
Autor do korespondencji
Barbara Pietrzyk
Katedra i Zakład Biofizyki Lekarskiej, Wydział Nauk Medycznych w Katowicach ŚUM, ul. Medyków 18, 40-752 Katowice
Katedra i Zakład Biofizyki Lekarskiej, Wydział Nauk Medycznych w Katowicach ŚUM, ul. Medyków 18, 40-752 Katowice
Ann. Acad. Med. Siles. 2025;79:261-268
SŁOWA KLUCZOWE
DZIEDZINY
STRESZCZENIE
Wstęp:
Większość dostępnych raportów naukowych na temat etiopatogenezy COVID-19 koncentruje się głównie na populacjach dorosłych z zaawansowanymi stadiami chorób przewlekłych, w tym ciężkimi zaburzeniami układów oddechowego i sercowo-naczyniowego, a także schorzeniami onkologicznymi, w których zaobserwowano korelację z przebiegiem klinicznym choroby. Przebieg kliniczny COVID-19 jest bardzo zmienny, od bezobjawowych lub łagodnych objawów do ciężkiej niewydolności oddechowej i krążeniowej oraz zgonu. Celem badania była ocena, czy powszechne choroby przewlekłe wpływają na nasilenie objawów klinicznych COVID-19.
Materiał i metody:
Badanie retrospektywne prowadzono w grupie 208 pacjentów w okresie od października 2022 r. do lutego 2023 r. Autorski kwestionariusz zawierał dane dotyczące objawów po COVID-19 i ich nasilenia (łagodne, umiarkowane lub ciężkie), częstości występowania oraz związku z chorobami współistniejącymi. Zastosowano statystyki opisowe, przy istotności statystycznej p < 0,05. Porównania zmiennych dokonano za pomocą testu χ².
Wyniki:
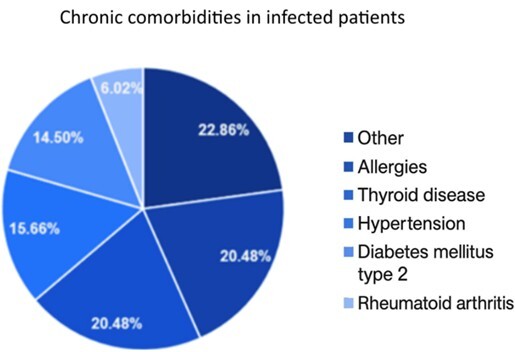
Spośród pacjentów 50,48% cierpiało na choroby przewlekłe, z czego u 55% wystąpiły łagodne objawy COVID-19, a u 40% umiarkowane. W grupie bez chorób przewlekłych (49,52%) łagodne objawy zaobserwowano u 58%, a umiarkowane u 36%. Nie stwierdzono istotnej korelacji między chorobami przewlekłymi a nasileniem objawów (p = 0,809).
Wnioski:
Nie stwierdzono istotnej korelacji między powszechnymi chorobami przewlekłymi a nasileniem objawów COVID-19. Rodzaj, nasilenie i czas trwania schorzeń, a także poziom wiremii wpływają na rokowanie. Konieczne są dalsze badania uwzględniające dodatkowe czynniki, takie jak płeć i wiek.
Większość dostępnych raportów naukowych na temat etiopatogenezy COVID-19 koncentruje się głównie na populacjach dorosłych z zaawansowanymi stadiami chorób przewlekłych, w tym ciężkimi zaburzeniami układów oddechowego i sercowo-naczyniowego, a także schorzeniami onkologicznymi, w których zaobserwowano korelację z przebiegiem klinicznym choroby. Przebieg kliniczny COVID-19 jest bardzo zmienny, od bezobjawowych lub łagodnych objawów do ciężkiej niewydolności oddechowej i krążeniowej oraz zgonu. Celem badania była ocena, czy powszechne choroby przewlekłe wpływają na nasilenie objawów klinicznych COVID-19.
Materiał i metody:
Badanie retrospektywne prowadzono w grupie 208 pacjentów w okresie od października 2022 r. do lutego 2023 r. Autorski kwestionariusz zawierał dane dotyczące objawów po COVID-19 i ich nasilenia (łagodne, umiarkowane lub ciężkie), częstości występowania oraz związku z chorobami współistniejącymi. Zastosowano statystyki opisowe, przy istotności statystycznej p < 0,05. Porównania zmiennych dokonano za pomocą testu χ².
Wyniki:
Spośród pacjentów 50,48% cierpiało na choroby przewlekłe, z czego u 55% wystąpiły łagodne objawy COVID-19, a u 40% umiarkowane. W grupie bez chorób przewlekłych (49,52%) łagodne objawy zaobserwowano u 58%, a umiarkowane u 36%. Nie stwierdzono istotnej korelacji między chorobami przewlekłymi a nasileniem objawów (p = 0,809).
Wnioski:
Nie stwierdzono istotnej korelacji między powszechnymi chorobami przewlekłymi a nasileniem objawów COVID-19. Rodzaj, nasilenie i czas trwania schorzeń, a także poziom wiremii wpływają na rokowanie. Konieczne są dalsze badania uwzględniające dodatkowe czynniki, takie jak płeć i wiek.
REFERENCJE (39)
1.
Bajgain K.T., Badal S., Bajgain B.B., Santana M.J. Prevalence of comorbidities among individuals with COVID-19: A rapid review of current literature. Am. J. Infect. Control 2021; 49(2): 238–246, doi: 10.1016/j.ajic.2020.06.213.
2.
Booth A., Reed A.B., Ponzo S., Yassaee A., Aral M., Plans D. et al. Population risk factors for severe disease and mortality in COVID-19: A global systematic review and meta-analysis. PLoS One 2021; 16(3): e0247461, doi: 10.1371/journal.pone.0247461.
3.
Opuchlik M., Opuchlik A.M., Żurawski A., Zabojszcz M., Biskup M., Markowski K. et al. Complications after COVID-19 – review of scientific reports and meta-analysis. Medical Studies/Studia Medyczne 2024; 40(2): 225–239, doi: 10.5114/ms.2024.140984.
4.
Zhang J.J., Dong X., Liu G.H., Gao Y.D. Risk and protective factors for COVID-19 morbidity, severity, and mortality. Clin. Rev. Allergy Immunol. 2023; 64(1): 90–107, doi: 10.1007/s12016-022-08921-5.
5.
Lauer S.A., Grantz K.H., Bi Q., Jones F.K., Zheng Q., Meredith H.R. et al. The incubation period of coronavirus disease 2019 (COVID-19) from publicly reported confirmed cases: estimation and application. Ann. Intern. Med. 2020; 172(9): 577–582, doi: 10.7326/M20-0504.
6.
Bean J., Kuri-Cervantes L., Pennella M., Betts M.R., Meyer N.J., Hassan W.M. Multivariate indicators of disease severity in COVID-19. Sci. Rep. 2023; 13(1): 5145, doi: 10.1038/s41598-023-31683-9.
7.
Mattiuzzi C., Lippi G. Timeline analysis of clinical severity of COVID-19 in the general population. Eur. J. Intern. Med. 2023; 110: 97–98, doi: 10.1016/j.ejim.2022.12.007.
8.
Kim G.U., Kim M.J., Ra S.H., Lee J., Bae S., Jung J. et al. Clinical characteristics of asymptomatic and symptomatic patients with mild COVID-19. Clin. Microbiol. Infect. 2020; 26(7): 948.e1–948.e3, doi: 10.1016/j.cmi.2020.04.040.
9.
da Costa E Silva G.R., Moura W.É.A., Dos Santos K.C., Gomes D.O., Bandeira G.N., Guimarães R.A. et al. Long-term symptoms after mild coronavirus disease in healthy healthcare professionals: A 12-month prospective cohort study. Int. J. Environ. Res. Public Health 2023; 20(2): 1483, doi: 10.3390/ijerph20021483.
10.
Narang K., Miller M., Trinidad C., Wick M., Theiler R., Weaver A.L. et al. Impact of asymptomatic and mild COVID-19 infection on fetal growth during pregnancy. Eur. J. Obstet. Gynecol. Reprod. Biol. 2023; 281: 63–67, doi: 10.1016/j.ejogrb.2022.12.020.
11.
Gandhi R.T., Lynch J.B., Del Rio C. Mild or moderate Covid-19. N. Engl. J. Med. 2020; 383(18): 1757–1766, doi: 10.1056/NEJMcp2009249.
12.
Bernell S., Howard S.W. Use your words carefully: What is a chronic disease? Front. Public Health 2016; 4: 159, doi: 10.3389/fpubh.2016.00159.
13.
Sepúlveda-Loyola W., Rodríguez-Sánchez I., Pérez-Rodríguez P., Ganz F., Torralba R., Oliveira D.V. et al. Impact of social isolation due to COVID-19 on health in older people: Mental and physical effects and recommendations. J. Nutr. Health Aging 2020; 24(9): 938–947, doi: 10.1007/s12603-020-1500-7.
14.
Mahumud R.A., Kamara J.K., Renzaho A.M.N. The epidemiological burden and overall distribution of chronic comorbidities in coronavirus disease-2019 among 202,005 infected patients: evidence from a systematic review and meta-analysis. Infection 2020; 48(6): 813–833, doi: 10.1007/s15010-020-01502-8.
15.
Shibata S., Arima H., Asayama K., Hoshide S., Ichihara A., Ishimitsu T. et al. Hypertension and related diseases in the era of COVID-19: a report from the Japanese Society of Hypertension Task Force on COVID-19. Hypertens. Res. 2020; 43(10): 1028–1046, doi: 10.1038/s41440-020-0515-0.
16.
Sun Y., Guan X., Jia L., Xing N., Cheng L., Liu B. et al. Independent and combined effects of hypertension and diabetes on clinical outcomes in patients with COVID-19: A retrospective cohort study of Huoshen Mountain Hospital and Guanggu Fangcang Shelter Hospital. J. Clin. Hypertens. 2021; 23(2): 218–231, doi: 10.1111/jch.14146.
17.
Gallo G., Calvez V., Savoia C. Hypertension and COVID-19: Current evidence and perspectives. High Blood Press. Cardiovasc. Prev. 2022; 29(2): 115–123, doi: 10.1007/s40292-022-00506-9.
18.
Williamson E.J., Walker A.J., Bhaskaran K., Bacon S., Bates C., Morton C.E. et al. Factors associated with COVID-19-related death using OpenSAFELY. Nature 2020; 584(7821): 430–436, doi: 10.1038/s41586-020-2521-4.
19.
Rosenthal N., Cao Z., Gundrum J., Sianis J., Safo S. Risk factors associated with in-hospital mortality in a US national sample of patients with COVID-19. JAMA Netw. Open. 2020; 3(12): e2029058, doi: 10.1001/jamanetworkopen.2020.29058.
20.
Tadic M., Cuspidi C., Grassi G., Mancia G. COVID-19 and arterial hypertension: Hypothesis or evidence? J. Clin. Hypertens. 2020; 22(7): 1120–1126, doi: 10.1111/jch.13925.
21.
Tadic M., Saeed S., Grassi G., Taddei S., Mancia G., Cuspidi C. Hypertension and COVID-19: Ongoing controversies. Front. Cardiovasc. Med. 2021; 8: 639222, doi: 10.3389/fcvm.2021.639222.
22.
El-Battrawy I., Nuñez-Gil I.J., Abumayyaleh M., Estrada V., Manuel Becerra-Muñoz V., Uribarri A. et al. COVID-19 and the impact of arterial hypertension-An analysis of the international HOPE COVID-19 Registry (Italy-Spain-Germany). Eur. J. Clin. Invest. 2021; 51(11): e13582, doi: 10.1111/eci.13582.
23.
Shalaeva E.V., Shadmanov A.K, Azizova F.L., Mirakhmedova K.T., Messerli F.H., Franco O.H. et al. Is lone hypertension a risk factor for more severe COVID-19 outcomes? Glob. Heart 2022; 17(1): 17, doi: 10.5334/gh.1099.
24.
Yoshihara F. Association between blood pressure and COVID-19 severity. Hypertens. Res. 2024; 47(3): 683–684, doi: 10.1038/s41440-023-01557-8.
25.
Drucker D.J. Diabetes, obesity, metabolism, and SARS-CoV-2 infection: the end of the beginning. Cell. Metab. 2021; 33(3): 479–498, doi: 10.1016/j.cmet.2021.01.016.
26.
Al-Kuraishy H.M., Al-Gareeb A.I., Alblihed M., Guerreiro S.G., Cruz-Martins N., Batiha G.E. COVID-19 in relation to hyperglycemia and diabetes mellitus. Front. Cardiovasc. Med. 2021; 8: 644095, doi: 10.3389/fcvm.2021.644095.
27.
Dandona P., Aljada A., Bandyopadhyay A. The potential therapeutic role of insulin in acute myocardial infarction in patients admitted to intensive care and in those with unspecified hyperglycemia. Diabetes Care 2003; 26(2): 516–519, doi: 10.2337/diacare.26.2.516.
28.
Maddaloni E., Buzzetti R. Covid-19 and diabetes mellitus: unveiling the interaction of two pandemics. Diabetes Metab. Res. Rev. 2020; 36(7): e33213321, doi: 10.1002/dmrr.3321.
29.
Kaminska H., Szarpak L., Kosior D., Wieczorek W., Szarpak A., Al-Jeabory M. Impact of diabetes mellitus on in-hospital mortality in adult patients with COVID-19: a systematic review and meta-analysis. Acta Diabetol. 2021; 58(8): 1101–1110, doi: 10.1007/s00592-021-01701-1.
30.
Wu C., Chen X., Cai Y., Xia J., Zhou X., Xu S. et al. Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China. JAMA Intern. Med. 2020; 180(7): 934–943, doi: 10.1001/jamainternmed.2020.0994.
31.
Zhou F., Yu T., Du R., Fan G., Liu Y., Liu Z. et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 2020; 395(10229): 1054–1062, doi: 10.1016/S0140-6736(20)30566-3.
32.
Liu H., Chen S., Liu M., Nie H., Lu H. Comorbid chronic diseases are strongly correlated with disease severity among COVID-19 patients: A systematic review and meta-analysis. Aging Dis. 2020; 11(3): 668–678, doi: 10.14336/AD.2020.0502.
33.
Guan W.J, Liang W.H., Zhao Y., Liang H.R., Chen Z.S., Li Y.M. et al. Comorbidity and its impact on 1590 patients with COVID-19 in China: a nationwide analysis. Eur. Respir. J. 2020; 55(5): 2000547, doi: 10.1183/13993003.00547-2020.
34.
Grasselli G., Zangrillo A., Zanella A., Antonelli M., Cabrini L., Castelli A. et al. Baseline characteristics and outcomes of 1591 patients infected with SARS-CoV-2 admitted to ICUs of the Lombardy region, Italy. JAMA 2020; 323(16): 1574–1581, doi: 10.1001/jama.2020.5394.
35.
Szarpak L., Mierzejewska M., Jurek J., Kochanowska A., Gasecka A., Truszewski Z. et al. Effect of coronary artery disease on COVID-19 – prognosis and risk assessment: A systematic review and meta-analysis. Biology 2022; 11(2): 221, doi: 10.3390/biology11020221.
36.
Sunjaya A.P., Allida S.M., Di Tanna G.L., Jenkins C. Asthma and risk of infection, hospitalization, ICU admission and mortality from COVID-19: Systematic review and meta-analysis. J. Asthma 2022; 59(5): 866–879, doi: 10.1080/02770903.2021.1888116.
37.
Terry P.D., Heidel R.E., Dhand R. Asthma in adult patients with COVID-19: Prevalence and risk of severe disease. Am. J. Respir. Crit. Care Med. 2021; 203(7): 893–905, doi: 10.1164/rccm.202008-3266OC.
38.
Singh D., Mathioudakis A.G., Higham A. Chronic obstructive pulmonary disease and COVID-19: interrelationships. Curr. Opin. Pulm. Med. 2022; 28(2): 76–83, doi: 10.1097/MCP.0000000000000834.
39.
Chuang H.J., Lin C.W., Hsiao M.Y., Wang T.G., Liang H.W. Long COVID and rehabilitation. J. Formos. Med. Assoc. 2024; 123 Suppl 1: S61–S69, doi: 10.1016/j.jfma.2023.03.022.
Udostępnij
ARTYKUŁ POWIĄZANY
Śląski Uniwersytet Medyczny w Katowicach, jako Operator Serwisu annales.sum.edu.pl, przetwarza dane osobowe zbierane podczas odwiedzania Serwisu. Realizacja funkcji pozyskiwania informacji o Użytkownikach i ich zachowaniu odbywa się poprzez dobrowolnie wprowadzone w formularzach informacje, zapisywanie w urządzeniach końcowych plików cookies (tzw. ciasteczka), a także poprzez gromadzenie logów serwera www, będącego w posiadaniu Operatora Serwisu. Dane, w tym pliki cookies, wykorzystywane są w celu realizacji usług zgodnie z Polityką prywatności.
Możesz wyrazić zgodę na przetwarzanie danych w tych celach, odmówić zgody lub uzyskać dostęp do bardziej szczegółowych informacji.
Możesz wyrazić zgodę na przetwarzanie danych w tych celach, odmówić zgody lub uzyskać dostęp do bardziej szczegółowych informacji.