Bieżący numer
O czasopiśmie
Rada Naukowa
Kolegium Redakcyjne
Polityka prawno-archiwizacyjna
Kodeks etyki publikacyjnej
Wydawca
Informacja o przetwarzaniu danych osobowych w ramach plików cookies oraz subskrypcji newslettera
Archiwum
Dla autorów
Dla recenzentów
Kontakt
Recenzenci
Recenzenci rocznika 2025
Recenzenci rocznika 2024
Recenzenci rocznika 2023
Recenzenci rocznika 2022
Recenzenci rocznika 2021
Recenzenci rocznika 2020
Recenzenci rocznika 2019
Recenzenci rocznika 2018
Recenzenci rocznika 2017
Recenzenci rocznika 2016
Recenzenci rocznika 2015
Recenzenci rocznika 2014
Recenzenci rocznika 2013
Recenzenci rocznika 2012
Polecamy
Śląski Uniwersytet Medyczny w Katowicach
Sklep Wydawnictw SUM
Biblioteka Główna SUM
Polityka prywatności
Deklaracja dostępności
Recenzenci
Recenzenci rocznika 2025
Recenzenci rocznika 2024
Recenzenci rocznika 2023
Recenzenci rocznika 2022
Recenzenci rocznika 2021
Recenzenci rocznika 2020
Recenzenci rocznika 2019
Recenzenci rocznika 2018
Recenzenci rocznika 2017
Recenzenci rocznika 2016
Recenzenci rocznika 2015
Recenzenci rocznika 2014
Recenzenci rocznika 2013
Recenzenci rocznika 2012
Histopatologiczna analiza próbek zmian w mózgu uzyskanych poprzez stereotaktyczną i nawigowaną biopsję mózgu – badanie kohortowe
1
Students’ Scientific Club, Department of Neurosurgery, Faculty of Medical Sciences in Katowice, Medical University of Silesia, Katowice, Poland
2
Department of Neurosurgery, Faculty of Medical Sciences in Katowice, Medical University of Silesia in Katowice, Poland
3
Department of Pediatric Surgery, Upper Silesian Children’s Health Center named after St. John Paul II, Independent Public Clinical Hospital No. 6, Medical University of Silesia, Katowice, Poland
Autor do korespondencji
Igor Andjelić
Klinika Neurochirurgii, Uniwersyteckie Centrum Kliniczne im. prof. K. Gibińskiego ŚUM, ul. Medyków 14, 40-752 Katowice
Klinika Neurochirurgii, Uniwersyteckie Centrum Kliniczne im. prof. K. Gibińskiego ŚUM, ul. Medyków 14, 40-752 Katowice
Ann. Acad. Med. Siles. 2026;80:51-58
SŁOWA KLUCZOWE
DZIEDZINY
STRESZCZENIE
Wstęp:
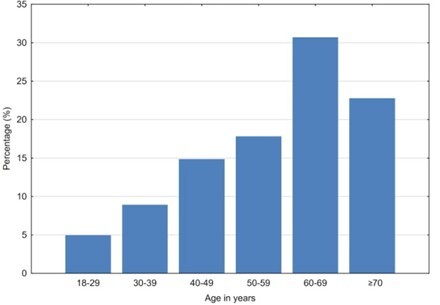
Guzy mózgu stanowią złożoną grupę nowotworów wywodzących się z różnych typów komórek ośrodkowego układu nerwowego. Ich klasyfikacja, oparta na cechach histopatologicznych i molekularnych, determinuje strategie terapeutyczne oraz rokowanie. Postępy w neuroobrazowaniu i technikach biopsji zwiększyły precyzję diagnostyczną, umożliwiając bardziej spersonalizowane i skuteczne metody leczenia. Biopsja mózgu (brain biopsy – BB) jest nieodzownym zabiegiem neurochirurgicznym, służącym do histologicznej diagnostyki nowotworowych zmian mózgu, odgrywającym kluczową rolę w postępowaniu z pacjentem. Celem badania jest ocena wyników histologicznych BB oraz identyfikacja grup wiekowych, rozkładu płci, topografii i różnych histologicznych typów guzów mózgu.
Materiał i metody:
Przeprowadzono retrospektywne badanie kohortowe w jednym z akademickich ośrodków medycznych, analizując 112 pacjentów poddanych BB w okresie od stycznia 2017 r. do sierpnia 2023 r. Badanie koncentrowało się na wynikach histologicznych oraz markerach molekularnych uzyskanych z biopsji stereotaktycznych i z użyciem neuronawigacji, oceniając skuteczność w uzyskiwaniu próbek diagnostycznych oraz zastosowanie systemu klasyfikacji nowotworów mózgu opracowanego przez Światową Organizację Zdrowia (World Health Organization – WHO). Analizowano również korelacje pomiędzy wynikami histologicznymi a powikłaniami.
Wyniki:
Badanie histologiczne potwierdziło wysoką skuteczność diagnostyczną BB, przy zbliżonej skuteczności metod stereotaktycznych i z zastosowaniem neuronawigacji. Do kategoryzacji zmian zastosowano klasyfikację nowotworów WHO, co również pozwoliło na zaplanowanie dalszego leczenia onkologicznego. Zaobserwowano niski odsetek powikłań, co potwierdza bezpieczeństwo procedury.
Wnioski:
Wyniki wskazują, że spektrum rozpoznań nowotworów mózgu u badanych pacjentów jest zbieżne z globalnymi trendami epidemiologicznymi. Zastosowanie klasyfikacji WHO umożliwiło zwiększenie precyzji diagnostycznej oraz ułatwiło standaryzację decyzji terapeutycznych.
Guzy mózgu stanowią złożoną grupę nowotworów wywodzących się z różnych typów komórek ośrodkowego układu nerwowego. Ich klasyfikacja, oparta na cechach histopatologicznych i molekularnych, determinuje strategie terapeutyczne oraz rokowanie. Postępy w neuroobrazowaniu i technikach biopsji zwiększyły precyzję diagnostyczną, umożliwiając bardziej spersonalizowane i skuteczne metody leczenia. Biopsja mózgu (brain biopsy – BB) jest nieodzownym zabiegiem neurochirurgicznym, służącym do histologicznej diagnostyki nowotworowych zmian mózgu, odgrywającym kluczową rolę w postępowaniu z pacjentem. Celem badania jest ocena wyników histologicznych BB oraz identyfikacja grup wiekowych, rozkładu płci, topografii i różnych histologicznych typów guzów mózgu.
Materiał i metody:
Przeprowadzono retrospektywne badanie kohortowe w jednym z akademickich ośrodków medycznych, analizując 112 pacjentów poddanych BB w okresie od stycznia 2017 r. do sierpnia 2023 r. Badanie koncentrowało się na wynikach histologicznych oraz markerach molekularnych uzyskanych z biopsji stereotaktycznych i z użyciem neuronawigacji, oceniając skuteczność w uzyskiwaniu próbek diagnostycznych oraz zastosowanie systemu klasyfikacji nowotworów mózgu opracowanego przez Światową Organizację Zdrowia (World Health Organization – WHO). Analizowano również korelacje pomiędzy wynikami histologicznymi a powikłaniami.
Wyniki:
Badanie histologiczne potwierdziło wysoką skuteczność diagnostyczną BB, przy zbliżonej skuteczności metod stereotaktycznych i z zastosowaniem neuronawigacji. Do kategoryzacji zmian zastosowano klasyfikację nowotworów WHO, co również pozwoliło na zaplanowanie dalszego leczenia onkologicznego. Zaobserwowano niski odsetek powikłań, co potwierdza bezpieczeństwo procedury.
Wnioski:
Wyniki wskazują, że spektrum rozpoznań nowotworów mózgu u badanych pacjentów jest zbieżne z globalnymi trendami epidemiologicznymi. Zastosowanie klasyfikacji WHO umożliwiło zwiększenie precyzji diagnostycznej oraz ułatwiło standaryzację decyzji terapeutycznych.
REFERENCJE (28)
1.
Ostrom QT, Francis SS, Barnholtz-Sloan JS. Epidemiology of Brain and Other CNS Tumors. Curr Neurol Neurosci Rep. 2021;21(12):68. doi: 10.1007/s11910-021-01152-9.
2.
Scheithauer BW. Development of the WHO Classification of Tumors of the Central Nervous System: A Historical Perspective. Brain Pathol. 2008;19(4):551–564. doi: 10.1111/j.1750-3639.2008.00192.x.
3.
Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol. 2016;131(6):803–820. doi: 10.1007/s00401-016-1545-1.
4.
Louis DN, Perry A, Wesseling P, Brat DJ, Cree IA, Figarella-Branger D, et al. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol. 2021;23(8):1231–1251. doi: 10.1093/neuonc/noab106.
5.
Hardigan AA, Jackson JD, Patel AP. Surgical Management and Advances in the Treatment of Glioma. Semin Neurol. 2023;43(6):810–824. doi: 10.1055/s-0043-1776766.
6.
Ma R, Taphoorn MJB, Plaha P. Advances in the management of glioblastoma. J Neurol Neurosurg Psychiatry. 2021;92(10):1103–1111. doi: 10.1136/jnnp-2020-325334.
7.
Rodríguez-Camacho A, Flores-Vázquez JG, Moscardini-Martelli J, Torres-Ríos JA, Olmos-Guzmán A, Ortiz-Arce CS, et al. Glioblastoma Treatment: State-of-the-Art and Future Perspectives. Int J Mol Sci. 2022;23(13):7207. doi: 10.3390/ijms23137207.
8.
Lee JH, Wee CW. Treatment of Adult Gliomas: A Current Update. Brain Neurorehabil. 2022;15(3):e24. doi: 10.12786/bn.2022.15.e24.
9.
Jia JL, Alshamsan B, Ng TL. Temozolomide Chronotherapy in Glioma: A Systematic Review. Curr Oncol. 2023;30(2):1893–1902. doi: 10.3390/curroncol30020147.
10.
Babaloui S, Najafi M, Mozdarani H, Borhani S, Jaberi R, Aghili M. Radiosensitization of Glioma Cells by Temozolomide (TMZ): A Colony Formation Assay. J Biomed Phys Eng. 2022;12(1):43–50. doi: 10.31661/jbpe.v0i0.1223.
11.
Kaina B, Beltzig L, Strik H. Temozolomide - Just a Radiosensitizer? Front Oncol. 2022;12:912821. doi: 10.3389/fonc.2022.912821.
12.
Curry RC, Dahiya S, Alva Venur V, Raizer JJ, Ahluwalia MS. Bevacizumab in high-grade gliomas: past, present, and future. Expert Rev Anticancer Ther. 2015;15(4):387–397. doi: 10.1586/14737140.2015.1028376.
13.
Tamura R, Tanaka T, Miyake K, Yoshida K, Sasaki H. Bevacizumab for malignant gliomas: current indications, mechanisms of action and resistance, and markers of response. Brain Tumor Pathol. 2017;34(2):62–77. doi: 10.1007/s10014-017-0284-x.
14.
Santos M, Roque R, Rainha Campos A, Albuquerque L, Pimentel J. Impact of brain biopsy on management of nonneoplastic brain disease. Brain Spine. 2022;2:100863. doi: 10.1016/j.bas.2022.100863.
15.
Jensen RL, Stone JL, Hayne RA. Introduction of the human Horsley–Clarke stereotactic frame. Neurosurgery. 1996;38(3):563–567; discussion 567. doi: 10.1097/00006123-199603000-00029.
16.
Rahman M, Murad GJA, Mocco J. Early history of the stereotactic apparatus in neurosurgery. Neurosurg Focus. 2009;27(3):E12. doi: 10.3171/2009.7.FOCUS09118.
17.
Orringer DA, Golby A, Jolesz F. Neuronavigation in the surgical management of brain tumors: current and future trends. Expert Rev Med Devices. 2012;9(5):491–500. doi: 10.1586/erd.12.42.
18.
Di Bonaventura R, Montano N, Giordano M, Gessi M, Gaudino S, Izzo A, et al. Reassessing the Role of Brain Tumor Biopsy in the Era of Advanced Surgical, Molecular, and Imaging Techniques–A Single-Center Experience with Long-Term Follow-Up. J Pers Med. 2021;11(9):909. doi: 10.3390/jpm11090909.
19.
Ivanov M, Ciurea AV. Neuronavigation. Principles. Surgical technique. J Med Life. 2009;2(1):29–35.
20.
Setyawan NH, Choridah L, Nugroho HA, Malueka RG, Dwianingsih EK. Beyond invasive biopsies: using VASARI MRI features to predict grade and molecular parameters in gliomas. Cancer Imaging. 2024;24(1):3. doi: 10.1186/s40644-023-00638-8.
21.
Chen J, Cen B, Hu F, Qiu Y, Xiao G, Zhou J, et al. Primary Brainstem Lymphoma: A Population-Based Study. Front Surg. 2022;9:829048. doi: 10.3389/fsurg.2022.829048.
22.
Trebouet A, Marchand T, Lemal R, Gyan E, Broussais-Guillaumot F, Guillermin Y, et al. Lymphoma occurring in patients over 90 years of age: characteristics, outcomes, and prognostic factors. A retrospective analysis of 234 cases from the LYSA. Ann Oncol. 2013;24(10):2612–2618. doi: 10.1093/annonc/mdt282.
23.
Choday S, Tran E, Gonzalez M. Diffuse large B-cell lymphoma: examining evolving patterns in mortality, incidence, and demographics. Clin Transl Oncol. 2025;27(8):3432–3438. doi: 10.1007/s12094-025-03859-4.
24.
Lopez Arini M. Diffuse Large B-Cell Lymphoma (DLBCL) / Epidemiology. Rare Disease Advisor [online] https://www.rarediseaseadvi-so... [accessed on 6 January 2024].
25.
Anderson MD, Gilbert MR. Treatment recommendations for anaplastic oligodendrogliomas that are codeleted. Oncology (Williston Park). 2013;27(4):315–320, 322.
26.
Ahmad H, Schiff D. Diffuse Gliomas (WHO Grade 2–3). In: Neuro-Oncology Compendium for the Boards and Clinical Practice. M.M. Mrugala, N.T. Gatson, J.L. Clarke, S.C. Kurz, K.S. Nevel. Oxford University Press; New York, 2023 [online edn]; p. 76–86. doi: 10.1093/med/9780197573778.003.0004.
27.
Kapoor M, Mukkamalla SKR, Gupta V. Astrocytoma. [Updated 2024 May 28]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-; https://www.ncbi.nlm.nih.gov/b....
28.
Giannini C, Scheithauer BW, Burger PC, Brat DJ, Wollan PC, Lach B, et al. Pleomorphic xanthoastrocytoma: what do we really know about it? Cancer. 1999;85(9):2033–2045.
Udostępnij
ARTYKUŁ POWIĄZANY
Śląski Uniwersytet Medyczny w Katowicach, jako Operator Serwisu annales.sum.edu.pl, przetwarza dane osobowe zbierane podczas odwiedzania Serwisu. Realizacja funkcji pozyskiwania informacji o Użytkownikach i ich zachowaniu odbywa się poprzez dobrowolnie wprowadzone w formularzach informacje, zapisywanie w urządzeniach końcowych plików cookies (tzw. ciasteczka), a także poprzez gromadzenie logów serwera www, będącego w posiadaniu Operatora Serwisu. Dane, w tym pliki cookies, wykorzystywane są w celu realizacji usług zgodnie z Polityką prywatności.
Możesz wyrazić zgodę na przetwarzanie danych w tych celach, odmówić zgody lub uzyskać dostęp do bardziej szczegółowych informacji.
Możesz wyrazić zgodę na przetwarzanie danych w tych celach, odmówić zgody lub uzyskać dostęp do bardziej szczegółowych informacji.