Bieżący numer
O czasopiśmie
Rada Naukowa
Kolegium Redakcyjne
Polityka prawno-archiwizacyjna
Kodeks etyki publikacyjnej
Wydawca
Informacja o przetwarzaniu danych osobowych w ramach plików cookies oraz subskrypcji newslettera
Archiwum
Dla autorów
Dla recenzentów
Kontakt
Recenzenci
Recenzenci rocznika 2025
Recenzenci rocznika 2024
Recenzenci rocznika 2023
Recenzenci rocznika 2022
Recenzenci rocznika 2021
Recenzenci rocznika 2020
Recenzenci rocznika 2019
Recenzenci rocznika 2018
Recenzenci rocznika 2017
Recenzenci rocznika 2016
Recenzenci rocznika 2015
Recenzenci rocznika 2014
Recenzenci rocznika 2013
Recenzenci rocznika 2012
Polecamy
Śląski Uniwersytet Medyczny w Katowicach
Sklep Wydawnictw SUM
Biblioteka Główna SUM
Polityka prywatności
Deklaracja dostępności
Recenzenci
Recenzenci rocznika 2025
Recenzenci rocznika 2024
Recenzenci rocznika 2023
Recenzenci rocznika 2022
Recenzenci rocznika 2021
Recenzenci rocznika 2020
Recenzenci rocznika 2019
Recenzenci rocznika 2018
Recenzenci rocznika 2017
Recenzenci rocznika 2016
Recenzenci rocznika 2015
Recenzenci rocznika 2014
Recenzenci rocznika 2013
Recenzenci rocznika 2012
Echokardiograficzne parametry przerostu lewej komory i remodelingu koncentrycznego – ograniczenia w diagnostyce amyloidozy serca, choroby Fabry’ego i kardiomiopatii przerostowej
1
1st Department of Cardiology, Faculty of Medical Sciences in Katowice, Medical University of Silesia, Katowice, Poland
Autor do korespondencji
Mateusz Tometczak
Klinika Kardiologii I Katedry Kardiologii, Górnośląskie Centrum Medyczne im. prof. Leszka Gieca Śląskiego Uniwersytetu Medycznego w Katowicach, ul. Ziołowa 47, 40-635 Katowice
Klinika Kardiologii I Katedry Kardiologii, Górnośląskie Centrum Medyczne im. prof. Leszka Gieca Śląskiego Uniwersytetu Medycznego w Katowicach, ul. Ziołowa 47, 40-635 Katowice
Ann. Acad. Med. Siles. 2024;78:219-225
SŁOWA KLUCZOWE
DZIEDZINY
STRESZCZENIE
Wstęp:
Przerost lewej komory (left ventricular hypertrophy – LVH) jest istotną cechą powiązaną ze wzrostem ryzyka nagłej śmierci sercowej. Typowe przyczyny przerostu obejmujące amyloidozę serca (cardiac amyloidosis – CA), chorobę Fabry’ego (Fabry disease – FD) oraz kardiomiopatię przerostową (hypertrophic cardiomyopathy – HCM) wymagają specyficznego podejścia i rokują niepomyślnie. Echokardiografia przezklatkowa (transthoracic echocardiography – TTE) pozostaje wówczas podstawową metodą diagnostyczną.
Materiał i metody:
Wykonano jednoośrodkową analizę retrospektywną obejmującą 86 pacjentów z przerostem ściany lewej komory (left ventricular – LV) stwierdzonym w TTE. Kryteriami włączenia były grubość przegrody międzykomorowej (interventricular septum – IVS) powyżej 10 mm u mężczyzn i 9 mm u kobiet oraz potwierdzona diagnoza CA, FD lub HCM. Badana populacja została podzielona na trzy grupy w zależności od końcowej diagnozy: CA (13 pacjentów), FD (7 pacjentów) oraz HCM (66 pacjentów). Analizowano indeks masy lewej komory (LV mass index – LVMI), względną grubość ściany lewej komory (relative wall thickness – RWT) oraz typ przerostu.
Wyniki:
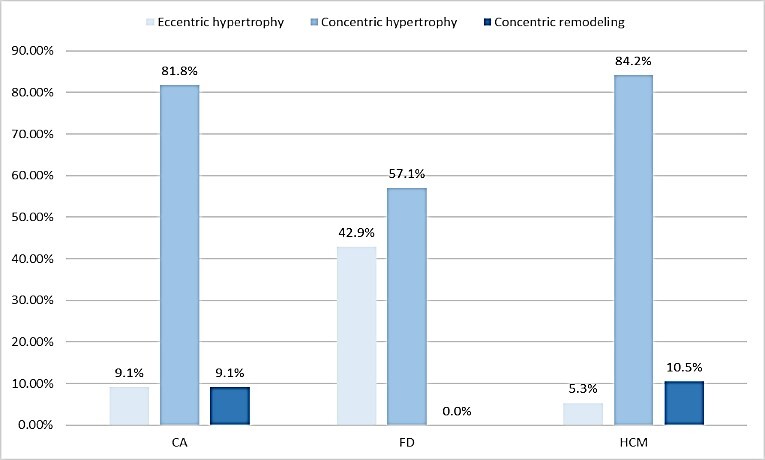
LVMI powyżej normy obserwowano u 90,9% pacjentów z CA, wszystkich z FD, 89,5% z HCM. RWT powyżej normy obserwowano u 92,3% pacjentów z CA, 57,1% z FD, 92,4% z HCM. Przerost koncentryczny zdiagnozowano u 75% pacjentów z CA, 57,1% z FD, 84,2% z HCM; przerost ekscentryczny zaobserwowano u 8,3% pacjentów z CA, 42,9% z FD, 5,3% z HCM (p = 0,01). IVS/PWT powyżej normy stwierdzono u 23,1% pacjentów z CA, 28,6% z FD, 79,7% z HCM (p = 0,00001).
Wnioski:
Mimo iż przerost serca jest cechą typową, nie występuje u wszystkich osób z CA, FD, HCM. Do scharakteryzowania konkretnych chorób, jak CA, FD, HCM, wymagana jest dokładniejsza analiza obejmująca typ przerostu oraz remodeling lewego przedsionka. Na podstawie wyników przerost asymetryczny jest bardziej swoisty dla HCM.
Przerost lewej komory (left ventricular hypertrophy – LVH) jest istotną cechą powiązaną ze wzrostem ryzyka nagłej śmierci sercowej. Typowe przyczyny przerostu obejmujące amyloidozę serca (cardiac amyloidosis – CA), chorobę Fabry’ego (Fabry disease – FD) oraz kardiomiopatię przerostową (hypertrophic cardiomyopathy – HCM) wymagają specyficznego podejścia i rokują niepomyślnie. Echokardiografia przezklatkowa (transthoracic echocardiography – TTE) pozostaje wówczas podstawową metodą diagnostyczną.
Materiał i metody:
Wykonano jednoośrodkową analizę retrospektywną obejmującą 86 pacjentów z przerostem ściany lewej komory (left ventricular – LV) stwierdzonym w TTE. Kryteriami włączenia były grubość przegrody międzykomorowej (interventricular septum – IVS) powyżej 10 mm u mężczyzn i 9 mm u kobiet oraz potwierdzona diagnoza CA, FD lub HCM. Badana populacja została podzielona na trzy grupy w zależności od końcowej diagnozy: CA (13 pacjentów), FD (7 pacjentów) oraz HCM (66 pacjentów). Analizowano indeks masy lewej komory (LV mass index – LVMI), względną grubość ściany lewej komory (relative wall thickness – RWT) oraz typ przerostu.
Wyniki:
LVMI powyżej normy obserwowano u 90,9% pacjentów z CA, wszystkich z FD, 89,5% z HCM. RWT powyżej normy obserwowano u 92,3% pacjentów z CA, 57,1% z FD, 92,4% z HCM. Przerost koncentryczny zdiagnozowano u 75% pacjentów z CA, 57,1% z FD, 84,2% z HCM; przerost ekscentryczny zaobserwowano u 8,3% pacjentów z CA, 42,9% z FD, 5,3% z HCM (p = 0,01). IVS/PWT powyżej normy stwierdzono u 23,1% pacjentów z CA, 28,6% z FD, 79,7% z HCM (p = 0,00001).
Wnioski:
Mimo iż przerost serca jest cechą typową, nie występuje u wszystkich osób z CA, FD, HCM. Do scharakteryzowania konkretnych chorób, jak CA, FD, HCM, wymagana jest dokładniejsza analiza obejmująca typ przerostu oraz remodeling lewego przedsionka. Na podstawie wyników przerost asymetryczny jest bardziej swoisty dla HCM.
REFERENCJE (20)
1.
Melero Polo J., Roteta Unceta-Barrenechea A., Revilla Martí P., Pérez-Palacios R., Gracia Gutiérrez A., Bueno Juana E. et al. Echocardiographic markers of cardiac amyloidosis in patients with heart failure and left ventricular hypertrophy. Cardiol. J. 2023; 30(2): 266–275, doi: 10.5603/CJ.a2021.0085.
2.
Tanaka H. Efficacy of echocardiography for differential diagnosis of left ventricular hypertrophy: special focus on speckle-tracking longitudinal strain. J. Echocardiogr. 2021; 19(2): 71–79, doi: 10.1007/s12574-020-00508-3.
3.
Lang R.M., Badano L.P., Mor-Avi V., Afilalo J., Armstrong A., Ernande L. et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur. Heart J. Cardiovasc. Imaging 2015; 16(3): 233–270, doi: 10.1093/ehjci/jev014. Erratum in: Eur. Heart J. Cardiovasc. Imaging 2016; 17(4): 412. Erratum in: Eur. Heart J. Cardiovasc. Imaging 2016; 17(9): 969.
4.
Bula K., Ćmiel A., Sejud M., Sobczyk K., Ryszkiewicz S., Szydło K. et al. Electrocardiographic criteria for left ventricular hypertrophy in aortic valve stenosis: Correlation with echocardiographic parameters. Ann. Noninvasive Electrocardiol. 2019; 24(5): e12645, doi: 10.1111/anec.12645.
5.
Wang S., Song K., Guo X., Xue H., Wang N., Chen J. et al. The association of metabolic syndrome with left ventricular mass and geometry in community-based hypertensive patients among Han Chinese. J. Res. Med. Sci. 2015; 20(10): 963–968, doi: 10.4103/1735-1995.172785.
6.
Chahal N.S., Lim T.K., Jain P., Chambers J.C., Kooner J.S., Senior R. New insights into the relationship of left ventricular geometry and left ventricular mass with cardiac function: A population study of hypertensive subjects. Eur. Heart J. 2010; 31(5): 588–594, doi: 10.1093/eurheartj/ehp490.
7.
Seko Y., Kato T., Haruna T., Izumi T., Miyamoto S., Nakane E. et al. Association between atrial fibrillation, atrial enlargement, and left ventricular geometric remodeling. Sci. Rep. 2018; 8(1): 6366, doi: 10.1038/s41598-018-24875-1.
8.
Stewart M.H., Lavie C.J., Shah S., Englert J., Gilliland Y., Qamruddin S. et al. Prognostic implications of left ventricular hypertrophy. Prog. Cardiovasc. Dis. 2018; 61(5–6): 446–455, doi: 10.1016/j.pcad.2018.11.002.
9.
Cardim N., Galderisi M., Edvardsen T., Plein S., Popescu B.A., D’Andrea A. et al. Role of multimodality cardiac imaging in the management of patients with hypertrophic cardiomyopathy: an expert consensus of the European Association of Cardiovascular Imaging Endorsed by the Saudi Heart Association. Eur. Heart J. Cardiovasc. Imaging 2015; 16(3): 280, doi: 10.1093/ehjci/jeu291.
10.
Maceira A.M., Cosín-Sales J., Roughton M., Prasad S.K., Pennell D.J. Reference left atrial dimensions and volumes by steady state free precession cardiovascular magnetic resonance. J. Cardiovasc. Magn. Reson. 2010; 12(1): 65, doi: 10.1186/1532-429X-12-65.
11.
Perry R., Selvanayagam J.B. Echocardiography in infiltrative cardiomyopathy. Heart Lung Circ. 2019; 28(9): 1365–1375, doi: 10.1016/j.hlc.2019.04.017.
12.
Nagueh S.F., Phelan D., Abraham T., Armour A., Desai M.Y., Dragulescu A. et al. Recommendations for multimodality cardiovascular imaging of patients with hypertrophic cardiomyopathy: An update from the American Society of Echocardiography, in collaboration with the American Society of Nuclear Cardiology, the Society for Cardiovascular Magnetic Resonance, and the Society of Cardiovascular Computed Tomography. J. Am. Soc. Echocardiogr. 2022; 35(6): 533–569, doi: 10.1016/j.echo.2022.03.012.
13.
Saeed S., Imazio M. Fabry disease: definition, incidence, clinical presentations and treatment – focus on cardiac involvement. Pak. J. Med. Sci. 2022; 38(8): 2337–2344, doi: 10.12669/pjms.38.8.7063.
14.
Yuasa T., Takenaka T., Higuchi K., Uchiyama N., Horizoe Y., Cyaen H. et al. Fabry disease. J. Echocardiogr. 2017; 15(4): 151–157, doi: 10.1007/s12574-017-0340-x.
15.
Patil P.V., Wiegers S.E. Echocardiography for hypertrophic cardiomyopathy. Prog. Cardiovasc. Dis. 2014; 57(1): 91–99, doi: 10.1016/j.pcad.2014.05.007.
16.
Haland T.F., Edvardsen T. The role of echocardiography in management of hypertrophic cardiomyopathy. J. Echocardiogr. 2020; 18(2): 77–85, doi: 10.1007/s12574-019-00454-9.
17.
Stankowski K., Figliozzi S., Battaglia V., Catapano F., Francone M., Monti L. Fabry disease: more than a phenocopy of hypertrophic cardiomyopathy. J. Clin. Med. 2023; 12(22): 7061, doi: 10.3390/jcm12227061.
18.
Liang S., Liu Z., Li Q., He W., Huang H. Advance of echocardiography in cardiac amyloidosis. Heart Fail. Rev. 2023; 28(6): 1345–1356, doi: 10.1007/s10741-023-10332-3.
19.
Falk R.H., Quarta C.C. Echocardiography in cardiac amyloidosis. Heart Fail. Rev. 2015; 20(2): 125–131, doi: 10.1007/s10741-014-9466-3.
20.
Dominguez F., González-López E., Padron-Barthe L., Cavero M.A., Garcia-Pavia P. Role of echocardiography in the diagnosis and management of hypertrophic cardiomyopathy. Heart 2018; 104(3): 261–273, doi: 10.1136/heartjnl-2016-310559.
Udostępnij
Śląski Uniwersytet Medyczny w Katowicach, jako Operator Serwisu annales.sum.edu.pl, przetwarza dane osobowe zbierane podczas odwiedzania Serwisu. Realizacja funkcji pozyskiwania informacji o Użytkownikach i ich zachowaniu odbywa się poprzez dobrowolnie wprowadzone w formularzach informacje, zapisywanie w urządzeniach końcowych plików cookies (tzw. ciasteczka), a także poprzez gromadzenie logów serwera www, będącego w posiadaniu Operatora Serwisu. Dane, w tym pliki cookies, wykorzystywane są w celu realizacji usług zgodnie z Polityką prywatności.
Możesz wyrazić zgodę na przetwarzanie danych w tych celach, odmówić zgody lub uzyskać dostęp do bardziej szczegółowych informacji.
Możesz wyrazić zgodę na przetwarzanie danych w tych celach, odmówić zgody lub uzyskać dostęp do bardziej szczegółowych informacji.